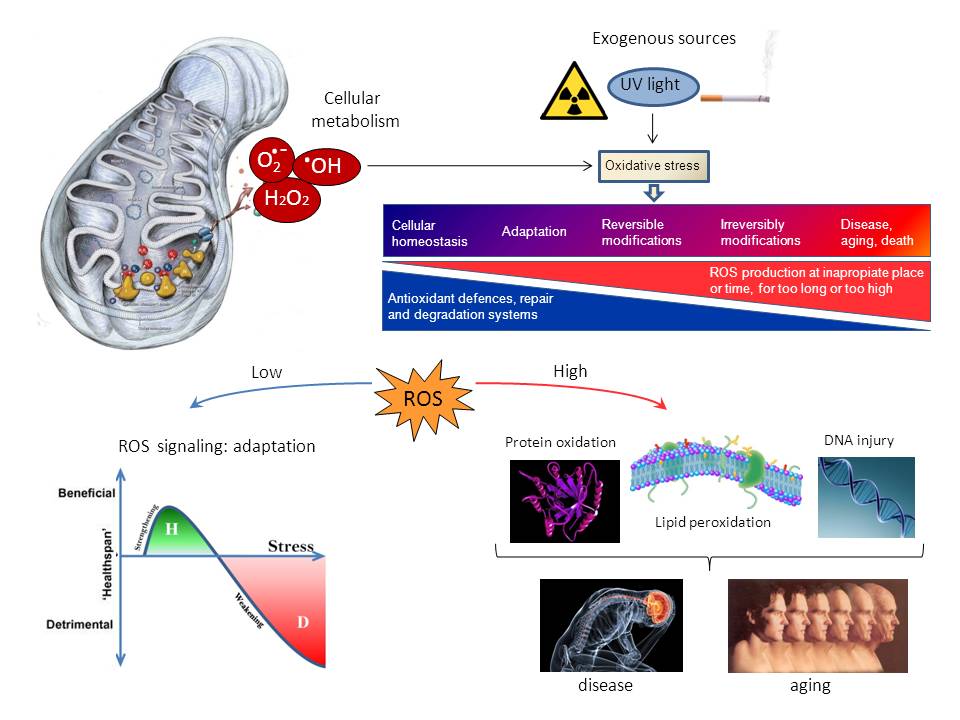
Los radicales libres oxidan el DNA, los lípidos y las proteínas, afectando su función y causando mutaciones. El envejecimiento se caracteriza por una acumulación de estas moléculas dañadas, un deterioro progresivo de los mecanismos de reparación y degradación y como consecuencia, la aparición de enfermedades asociadas a la vejez. Pero a dosis bajas, estos radicales activan sistemas de defensa, promoviendo un efecto beneficioso denominado hormesis.
¿Por qué los organismos vivos envejecen? Aunque parezca extraño, el estudio de los cambios moleculares que ocurren durante el envejecimiento no se llevó a cabo de forma sistemática sino en las dos últimas décadas. Y eso es así porque el envejecimiento se consideraba un proceso natural e irreversible. Pero no todos envejecemos de la misma forma y las alteraciones propias de la vejez y sus patologías asociadas no afectan a todos por igual. El estudio de estos cambios permite entender qué sucede y por qué para así buscar formas de evitarlos o por lo menos minimizarlos. Existen diversas teorías que intentan explicar por qué envejecemos y aquí entran en juego los denominados comúnmente radicales libres.
El oxígeno (O2) es necesario para la vida de la mayoría de los seres vivos ya que actúa, en la respiración mitocondrial, como aceptor final de cuatro electrones, dando lugar a una molécula de agua. Pero cuando la reducción del oxígeno es parcial, se generan especies reactivas derivadas. Así, cuando capta un electrón, se produce el radical superóxido (O2.-), que puede dar lugar a peróxido de hidrógeno (H2O2) y al radical hidroxilo (HO.), el más tóxico de todos (1). El término radical o radical libre, se refiere a cualquier molécula o átomo que contiene al menos un electrón desapareado. En general es muy reactivo hacia otras moléculas, lo que le confiere inestabilidad y vida media muy corta. Así, el radical superóxido o el radical hidroxilo son radicales libres, mientras que el peróxido de hidrógeno no lo es. Por ello, de forma más correcta se las denomina especies reactivas del oxígeno (ROS) aunque también existen las especies reactivas del nitrógeno (RNS) derivadas del óxido nítrico. La presencia del oxígeno, y especialmente sus especies reactivas derivadas, provocan problemas con los que las células han lidiado a lo largo de la evolución, desarrollando un complejo sistema de defensa antioxidante (2).
Las especies reactivas tienden a captar electrones de otras moléculas que se encuentren a su alrededor, entre ellas ADN, lípidos y proteínas. La oxidación del ADN puede provocar alteraciones en sus bases, como la formación de 8-hidroxiguanosina, utilizado como marcador de daño genético, o la rotura de la doble hélice, entre otras alteraciones mutagénicas. Por ello, las células disponen de sofisticados sistemas de reparación del ADN. La oxidación de lípidos denominada peroxidación lipídica afecta principalmente a las membranas celulares, siendo especialmente tóxica dado que se generan reacciones en cadena. La vitamina E, en combinación con la vitamina C, puede frenar esta oxidación en cadena y posteriormente, los sistemas de reparación lipídica sustituyen los ácidos grasos dañados. Como en el caso del ADN, se producen también roturas de lípidos dando lugar a compuestos como el malondialdehido o el 4-hidroxinonenal, que son marcadores de daño lipídico. La oxidación en proteínas afecta principalmente a la cadena lateral de los aminoácidos. Entre las modificaciones reversibles tenemos las que afectan a los grupos sulfidrilo de las cisteínas, dando lugar a puentes disulfuro, conjugación con glutatión o ácido sulfénico. La metionina, otro aminoácido con un átomo de azufre, se oxida dando metionina sulfóxido. Todas estas oxidaciones pueden ser reducidas por distintos sistemas enzimáticos y por tanto pueden actuar como mecanismos de regulación de la función proteica. Entre las oxidaciones irreversibles tenemos una gran variedad de productos, destacando la formación de grupos carbonilo (aldehídos o cetonas) en lisina, prolina, arginina y treonina, que son utilizados como marcadores de daño a proteínas y que en la mayoría de los casos la inactivan. Dado que no existen sistemas de reparación, estas proteínas oxidadas deben ser degradadas. Cuando los sistemas de degradación, como el proteasoma, no son capaces de eliminarlas de forma adecuada, bien porque están en exceso o por deterioro del propio proteasoma, las proteínas oxidadas se acumulan en el interior celular, provocando toxicidad o muerte celular (3).
El envejecimiento se caracteriza por una acumulación de todas estas macromoléculas dañadas y un desgaste progresivo de los mecanismos de reparación y degradación. Esta situación de estrés oxidativo en la que la generación de ROS (endógena o causada por fuentes externas como la radiación, tabaco,…) supera la capacidad antioxidante celular, puede explicar la elevada incidencia de tumores a edades avanzadas o que el tejido cardíaco y el sistema nervioso estén especialmente afectados, dado que sus células no se dividen.
Pero existe otra cara de la moneda: en situaciones de estrés oxidativo leve, las especies reactivas y sus derivados actúan como moléculas señalizadoras, promoviendo efectos beneficiosos en diferenciación, defensa antioxidante y mecanismos compensatorios. Ejemplos bien conocidos son la activación, por oxidación de cisteínas, de factores transcripcionales (como Nrf2-Keap1), que inducen sistemas antioxidantes de defensa (4). El término hormesis describe esta respuesta favorable a bajas dosis de un agente oxidante y explica por qué las células previamente sometidas a un estrés leve resisten mucho mejor un estrés intenso que las células no adaptadas. Es posible que administrar bajas dosis de moléculas pro-oxidantes con el fin de aumentar los sistemas endógenos de defensa sea una aproximación mejor en el tratamiento y prevención de enfermedades que añadir grandes dosis de antioxidantes a la dieta, que sabemos se ha demostrado ineficaz. En los últimos años, se está estudiando el papel de la hormesis en el envejecimiento o como tratamiento de enfermedades asociadas, como el cáncer, la diabetes o las enfermedades neurodegenerativas (5).
REFERENCIAS
1. Molina-Heredia FP. 2012. El lado oscuro del oxígeno. http://www.sebbm.es/ES/divulgacion-ciencia-para-todos_10/el-lado-oscuro-del-oxigeno_678
2. http://en.wikipedia.org/wiki/Antioxidant
3. Radak Z, Zhao Z, Goto S, Koltai E. 2011. Age-associated neurodegeneration and oxidative damage to lipids, proteins and DNA. Mol Aspects Med. 32:305-315.
4. Mitsuishi Y, Motohashi H, Yamamoto M. 2012. The Keap1-Nrf2 system in cancers: stress response and anabolic metabolism. Front Oncol. 2: 200.
5. Mao L, Franke J. 2013. Hormesis in aging and neurodegeneration-a prodigy awaiting dissection. Int J Mol Sci. 14: 13109-13128.





Dejar un comentario